HERPESVIRUS BOVINO TIPO 4
EN LA REPRODUCCIÓN BOVINA
El virus puede estar involucrado en metritis y abortos
El objetivo de este artículo es revisar y discutir la información disponible en la actualidad respecto a la relación del BoHV-4 con las diferentes patologías reproductivas bovinas.
José Manuel Díaz Cao [1], Alberto Prieto [1], Pablo Díaz [1], Javier Moral [2], Antonio Iglesias [3], Luis Ángel Quintela [4], Patrocinio Morrondo [1] y Gonzalo Fernández [1].
El herpesvirus bovino 4 (BoHV-4) ha adquirido una progresiva consideración en la patología reproductiva bovina en los últimos años y sin embargo es relativamente desconocido en la práctica clínica veterinaria. Su asociación con la enfermedad clínica ha sido siempre un tema controvertido, al aislarse tanto en animales sanos como en otros con diversidad de signos clínicos. El BoHV-4 comparte algunas características con otros herpesvirus bovinos (como el responsable de la IBR): es capaz de establecer infecciones latentes que pueden reactivarse ante un estímulo inmunosupresor (Dubuisson et al., 1989); pero en general, presenta importantes diferencias, sobre todo a nivel biológico, genético y antigénico. De forma general, se considera que la principal célula de latencia son los macrófagos (Donofrio y van Santen, 2001). Esto supone un arma de doble filo a la hora de entender la asociación del patógeno con la enfermedad. Por un lado, justifica su presentación en diferentes patologías: la llamada a las células inflamatorias tras una infección localizada puede llevar a que el virus sea transportado hasta la zona lesionada, dónde puede replicarse activamente y contribuir al agravamiento del proceso. Pero, por otra parte, no permite descartar fácilmente que la detección del virus sea debida a que sea transportado a una zona inflamada desempeñando un efecto testimonial. En este contexto, cuando han intentado reproducirse diferentes signos clínicos experimentalmente, la obtención de un cuadro clínico similar al detectado en los animales ha tenido un éxito variable e inconsistente. Por lo que en el pasado ha sido considerado un virus pasajero (Thiry et al., 2000). Sin embargo, una serie de artículos recientes han llamado la atención respecto a su potencial asociación con enfermedades reproductivas, principalmente metritis. Además, estudios in vitro han demostrado su tropismo por las células endometriales (Donofrio et al., 2007).
Metritis
Las metritis posparto bovinas son una de las principales manifestaciones clínicas en las que se ha sospechado de la implicación del BoHV-4. A nivel de campo se relaciona con el establecimiento de brotes de metritis graves que no responden bien a los tratamientos antibióticos. La primera vez que se aisló el BoHV-4 en casos de este tipo data de 1973 (Parks y Kendrick, 1973) y desde entonces han sido numerosas las ocasiones en las que el virus ha sido detectado en las descargas vaginales de animales con metritis. A pesar de ello, solo existe la reproducción experimental con signos clínicos similares y reaislamiento vírico, con la inoculación de la cepa LVR-140 en vacas gestantes (Wellemans et al., 1986). El resultado fue la aparición de metritis tras la gestación, pero sin demostrar una asociación primaria.
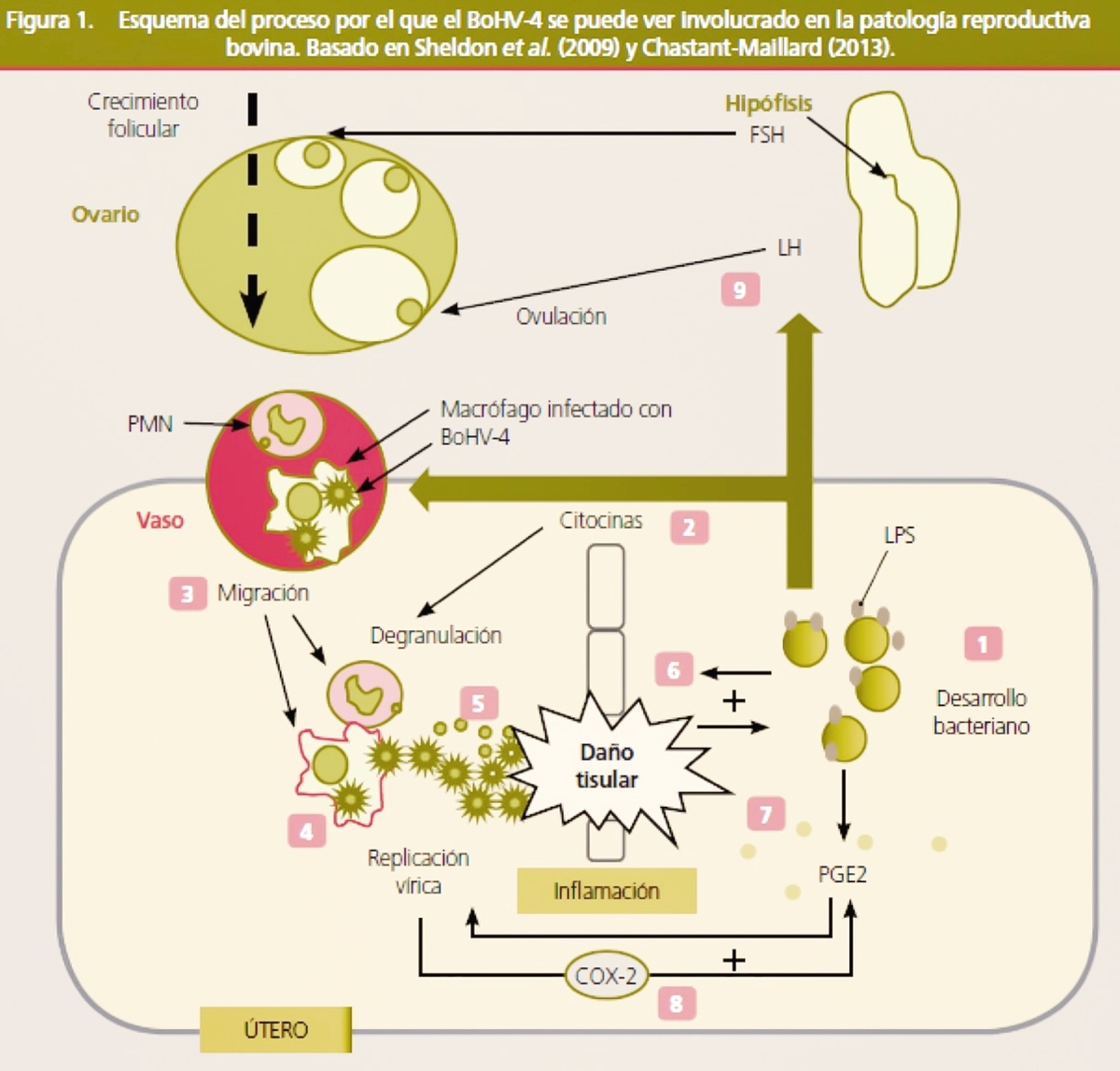
No obstante, en los últimos años, varios trabajos han comunicado la asociación entre la aparición de metritis y la presencia del patógeno (Frazier et al., 2002; Monge et al., 2006; Welchman et al., 2012). Graham et al. (2005) detectaron también la presencia del virus en animales con clínica, pero sin diferencias serológicas entre animales afectados y sanos, cuestionando la implicación del virus como agente patógeno primario. En este sentido, es un hecho frecuente el aislamiento de otros patógenos bacterianos, reconocidos responsables de enfermedad uterina (Trueperella pyogenes, Streptococcus spp., Escherichia coli), en concomitancia con la detección del virus en descargas vaginales (Banks et al., 2008; Graham et al., 2005; Monge et al., 2006; Welchman et al., 2012). Esto ha llevado a proponer un rol secundario del virus como agente favorecedor de la acción patógena de estas bacterias. Donofrio et al. (2005) mostraron que la replicación del BoHV-4 se ve estimulada por la prostaglandina E2. Esta sustancia puede producirse en el endometrio como consecuencia de una inflamación debida al desarrollo bacteriano, de forma que puede activar la replicación vírica provocando la lisis de las células endometriales y creando un ambiente favorable para el desarrollo bacteriano (figura 1).
1. La colonización bacteriana es fisiológica tras el parto. El desarrollo bacteriano progresivo va ligado al aumento de la concentración de lipopolisacáridos de membrana (LPS). 2. La presencia de LPS estimula la producción de citocinas. 3. Las citocinas atraen a los macrófagos (infectados con el virus) y a los polimorfonucleares (PMN) al útero por diapédesis. 4. Los macrófagos activados por LPS estimulan la replicación del BoHV-4 y la liberación de varios tipos de citocinas. 5. El BoHV-4 puede infectar las células endometriales causando daño tisular. A su vez estimula la síntesis de determinadas citocinas, como la IL-8, un potente factor quimiotáctico y activador de los PMN. La desgranulación de los PMN en su lucha por detener la infección contribuye al daño tisular. La persistencia de los PMN en ausencia de bacterias es conocida como una característica común de las endometritis subclínicas. 6. El daño tisular favorece el desarrollo bacteriano estableciéndose un feedback positivo. 7. Como resultado de los mecanismos de inflamación y del desarrollo bacteriano se estimula la producción de PGE2 que a su vez estimula la replicación vírica. 8. El BoHV-4 estimula la actividad de la ciclooxigenasa-2 (COX-2), estimulando la secreción de PGE2 por las células endometriales. De nuevo se instaura un feedback positivo. 9. Los LPS bacterianos pueden reducir la secreción de GnRH y LH reduciendo la capacidad para ovular. Sin embargo, no parecen afectar a FSH. La presencia de LPS se ve favorecida indirectamente por la replicación viral.
ARTICULO COMPLETO HERPESVIRUS BOVINO TIPO 4 EN LA REPRODUCCIÓN BOVINA

