PREPARTO DE LA VACA LECHERA
1. Introducción
La vaca lechera con elevada producción se ve forzada a realizar ajustes metabólicos importantes al momento del par to. Cuando estos fallan sobrevienen enfermedades como la paresia puerperal (PP) o «Fiebre de la leche». 
La PP es un síndrome que se presenta dentro de las 48 horas del parto, especialmente en vacas de alta producción y con varios par tos. Los animales presentan incoordinación e inestabilidad al caminar, caen y permanecen en decúbito esternal, en ocasiones con la cabeza orientada hacia su flanco (autoauscultación), el animal se muestra apático, con los músculos fláccidos y si no son tratados pasan a un estado comatoso en decúbito lateral y mueren. La temperatura corporal tiende a descender, salvo en la primera etapa por el esfuerzo muscular por no caerse, por lo cual la denominación de «Fiebre de la leche» sería incorrecta.
La causa de la PP es una deficiencia aguda de calcio (Ca) provocada por la brusca pérdida de este elemento hacia el calostro al momento del parto. La vaca puede afrontar esta exigencia aumentado la captación intestinal del Ca o bien movilizando el Ca desde el hueso. Ambos mecanismos son eficientes, y de hecho mantienen el aporte de Ca hacia la leche en pleno pico de lactancia, pero poseen una gran limitante: son lentos para comenzar a funcionar. Ambos mecanismos poseen un período de latencia entre el estímulo, que es la disminución de la calcemia, y la respuesta que es el restablecimiento de la calce-mia por captación del Ca desde el intestino o desde el hueso (FIGURA 1).  Esta latencia es el tiempo necesario para que la caída de la calcemia es timule a la glándula par atiroidea para que secrete parathormona (PTH), la cual vía sanguínea llega al riñón para estimular la formación de vitamina D activa, y recién ambas podrán actuar sobre el intestino, donde aumentan expresión de los transportadores de Ca y sobre el hueso donde activan macrófagos especializados llamados osteoclastos que «disuelven» el hueso y liberan sus minerales a la sangre. La PTH también ayuda al balance de Ca disminuyendo las pérdidas por orina. Este período de latencia explica porqué los casos de PP,
Esta latencia es el tiempo necesario para que la caída de la calcemia es timule a la glándula par atiroidea para que secrete parathormona (PTH), la cual vía sanguínea llega al riñón para estimular la formación de vitamina D activa, y recién ambas podrán actuar sobre el intestino, donde aumentan expresión de los transportadores de Ca y sobre el hueso donde activan macrófagos especializados llamados osteoclastos que «disuelven» el hueso y liberan sus minerales a la sangre. La PTH también ayuda al balance de Ca disminuyendo las pérdidas por orina. Este período de latencia explica porqué los casos de PP,
Figura 1: Mecanismos homeostáticos de regulación de la calcemia.
se presentan fundamentalmente dentro de las 24 horas del parto; ya que los animales que logran permanecer parados las primeras 48 horas posparto ya tendrán las vías intestinal y ósea funcionando y habrán salvado el problema (Under wood and Suttle, 1999).
La alternativa terapéutica para evitar la PP es mantener activos estos mecanismos de compensación, vale decir lograr bajar la calcemia antes del parto y no en ese mismo momento. Este fundamento dio origen a la idea de aportar poco Ca en la dieta prepar todo bien desequilibrar la relación Ca:P en la dieta elevando al segundo para originar con el exceso de P una carencia relativa de Ca que estimule la movilización ósea. Estas técnicas sin embargo han tenido resultados variables, en ocasiones muy poco exitosos. Posiblemente esto se deba por un lado a que reducir el apor te de Ca por la dieta puede ser difícil por las concentraciones normales de Ca en los alimentos disponibles, y además al ajustarse el aporte de Ca se modificó el aporte de otros elementos, como el potasio (K), que actualmente se consideran tanto o más impor tantes que la concentración de calcio en el desencadenamiento de la PP. Por otro lado aumentando el aporte de P en la diet a por encima de 80 gramos diarios comienza a inhibirse la activación renal de vitamina D, bloqueando la recuperación de la calcemia y así el propio fundamento de la técnica. También se han desarrollado terapias hormonales usando vitamina D o PTH que pueden dar buenos resultados, pero poseen como limitante que deben ajustarse con precisión al día del parto (Horst et al., 1997).
Otra alternativa que se ha generalizado es el consumo de sales aniónicas en el prepar to, las cuales cambian el balance catiónico – aniónico de la dieta, causando una acidosis metabólica moderada que favorece la resistencia a la PP.
El objetivo de este trabajo es comprender el fundamento del empleo de sales aniónicas y su utilidad en la prevención de la PP. Previamente se revisan algunos conceptos básicos que facilitarán la comprensión del tema.
2. Conceptos básicos en el fundamento del empleo de dietas aniónicas
¿Qué son los aniones y cationes?
Todos los elementos, como el sodio (Na), el cloro (Cl), el potasio (K), etc., se encuentran en la naturaleza en estado electro-neutro, ya que poseen igual cantidad de cargas positivas, aportadas por los protones del núcleo, y de cargas negativas aportados por los electrones que giran a su alrededor. La cantidad de protones o electrones es propia de cada elemento y se utilizan para ordenar los elementos en forma creciente en la tabla periódica. Cuando los elementos reaccionan entre si siempre conservan sus cargas positivas en el nucleo, pero los electrones se estabilizan completando su órbita externa con dos u ocho electrones, tomando la configuración electrónica del gas noble más próximo en la Tabla Periódica. Por ejemplo el cloro que posee 17 electrones, colocará dos de ellos en el primer orbital, ocho en el segundo y los siete que le quedan en el tercer orbital, o sea que para estabilizarse tomará otro electrón del medio. Al hacerlo queda con 18 electrones, uno más que el número de protones de su núcleo, por lo cual el elemento queda con una carga negativa, de allí que se exprese como Cl – . Algo similar ocurre con el sodio que posee 11 electrones, y los ordena colocando dos en el primer orbital, ocho en el segundo y sólo uno en el tercero. Para estabilizarse cede un electrón y queda con una carga positiva de más, por lo cual se lo cita como Na + . Cuando los elementos ordenan sus orbitales y adquieren cargas se denominaniones, y a su vez si captan electrones y adquieren carga negativa se denominan aniones, mientras que aquellos que ceden electrones para estabilizarse y adquieren cargas positivas se denominan cationes. La posibilidad de que los iones tomen o cedan electrones existen sólo cuando están disueltos en soluciones acuosas, donde pueden ceder o tomar electrones de otros átomos. Cuando no están disueltos, estos elementos deben lograr el equilibrio asociándose entre si, de modo que un anión que busca captar electrones se combina con un catión que busca cederlos y forman así las sales, como ocurriría por ejemplo con el cloruro de sodio (NaCl – Figura 2). Cuando el catión es bivalente (dos cargas positivas) como el Mg +2 por ejemplo, formará una sal con un anión bivalente como un sulfato (SO 4 ) o bien con dos aniones monovalentes como dos cloruros (Cl – ), pero siempre se neutralizarán. Cuando estas sales se disuelven en el organismo toman nuevamente carga eléctrica Para expresar la cantidad de cargas eléctricas que aporta un elemento en una solución se emplea una unidad llamada miliequivalente por litro, que representa un número determinado de cargas igual a 6 por 10 20 cargas eléctricas. Así un miliequivalente de Na + , de Mg +2 , o de cualquier otro catión indica que por litro de solución existen 6 por 10 20 cargas eléctricas positivas, mientras que un miliequivalente de Cl – , SO 4 = , PO4 -3 o de cualquier otro anión indica que por litro de solución existen 6 por 10 20 cargas eléctricas negativas apor tada por ese elemento.
¿Cómo es el equilibrio entre aniones y cationes en el organismo? Principio de electroneutralidad?
El organismo contiene más del 50 % de agua, la cual se encuentra dividida en tres compartimientos hídricos: el intracelular, que es el más abundante (60-70 %) y el extracelular, llamado también medio interno, y que incluye al líquido intravascular o plasmático (25 %) y al líquido intersticial (75%), que baña las células. En los tres compar timientos la cantidad de cargas positivas y negativas es igual, vale decir que existen en cada uno igual cantidad de miliequivalentes de cationes que de aniones FIGURA 3. Este principio, llamado de electroneutralidad, se mantiene siempre, de modo que si a un compar timiento ingresa un miliequivalente de un ión, otro miliequivalente de igual carga debe eliminarse para mantener el equilibrio.
¿De qué modo el equilibrio eléctrico afecta al pH?
El pH es un parámetro fisiológico que permite evaluar el es tado ácido-base del organismo. El valor de pH indica la concentración de hidrogeniones (H + ), pero expresada como el logaritmo negativo de su concentración (-log [H + ]), de modo de convertir unidades muy pequeñas y variables en un rango lineal que
FIGURA 2. Estabilización de átomos de sodio y cloro mediante la formación de sales o de iones en solución acuosa.
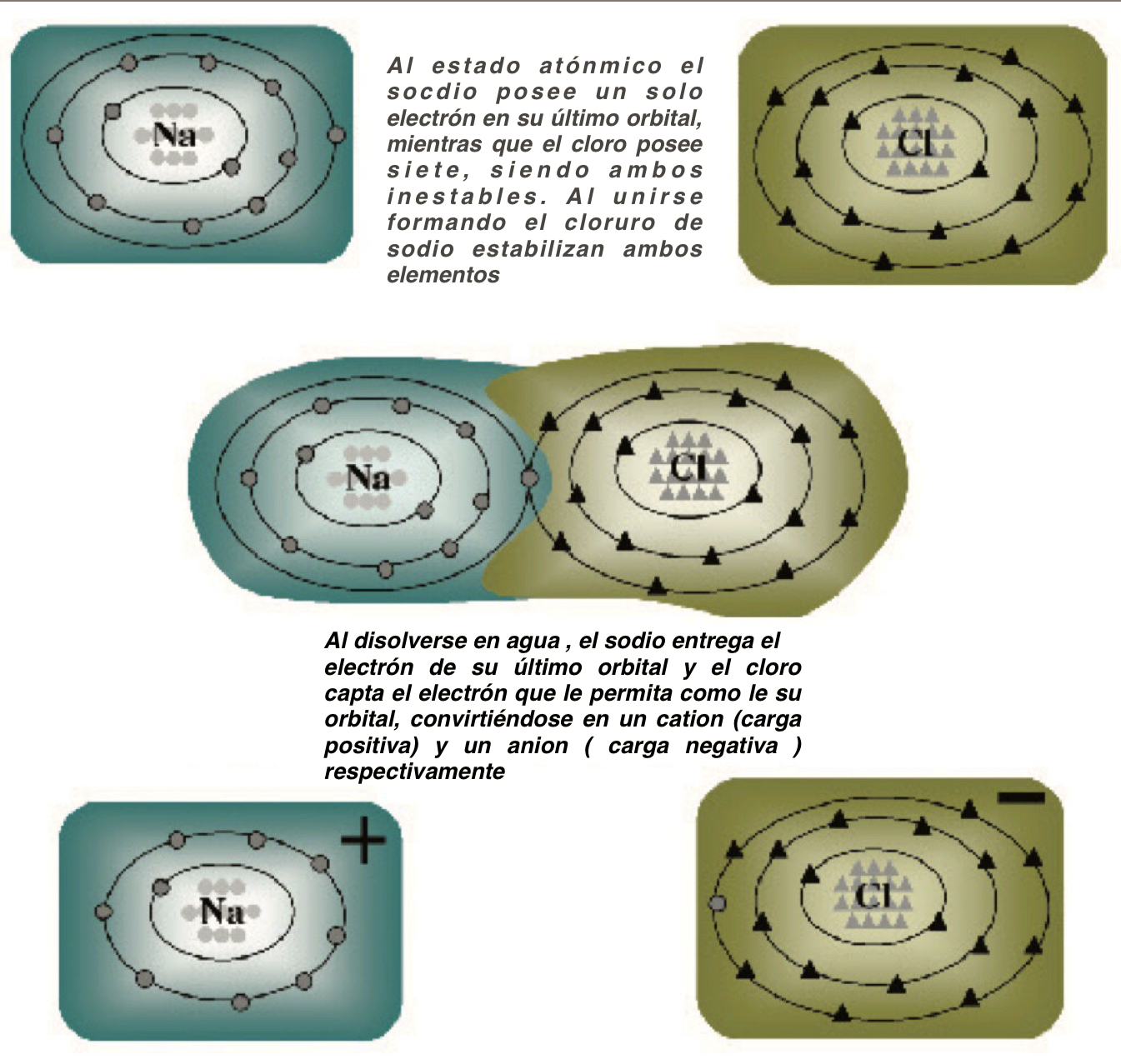
FIGURA 3. Distribución de cargas eléctricas en los compartimientos hídricos del organismo.
va de 1 (máxima concentración de H + ) a 14 (mínima concentración de H + ). El pH en el medio interno es mantenido alrededor de 7,40 y cuando disminuye se habla de acidosis, que implica una acumulación excesiva de H + . Según las escuelas más clásicas el pH de una solución se mantenía constante gracias a amor tiguadores o buffers, los cuales son sim plemente sustancias capaces de captar o ceder H + manteniendo su concentración normal. En la década del 80 el médico Canadiense Peter Stewart propone que la concentración de H + es apenas una consecuencia en el ajuste de otros factores primarios, entre los que incluye la diferencia de iones fuertes. Los iones fuertes son aquellos que ejercen mayor importancia eléctrica en el medio, como el sodio, el potasio y el cloro. Según el autor al ingresar cationes fuertes, como el sodio y el potasio, el medio interno mantiene la electroneutralidad desplazando otros cationes como el H + , causando alcalosis. Por el contrario, un ingreso de aniones fuertes ocasiona un aumento compensatorio de cationes débiles como los H + , causando acidosis.
ARTICULO COMPLETO BALANCE ANIONICO-CATIONICO EN EL PREPARTO DE LA VACA LECHERA

